EL ÁTOMO
El átomo es la unidad de materia más pequeña de un elemento químico que mantiene su identidad o sus propiedades, y que no es posible dividir mediante procesos químicos. Está compuesto por un núcleo atómico, en el que se concentra casi toda su masa, rodeado de una nube de electrones. El núcleo está formado por protones, con carga positiva, y neutrones, eléctricamente neutros. Los electrones, cargados negativamente, permanecen ligados a este mediante la fuerza electromagnética.

http://www.youtube.com/watch?v=tfzr7Yjv3-M
LA TABLA PERIÓDICA
La tabla periódica de los elementos clasifica, organiza y distribuye los distintos elementos químicos, conforme a sus propiedades y características; su función principal es establecer un orden específico agrupando elementos.

http://www.youtube.com/watch?v=z_SjCm-Tgjg
LOS ISOTOPOS
Se denominan isotopos a los átomos de un mismo elemento, cuyos núcleos tienen una cantidad diferente de neutrones, y por lo tanto, difieren en masa atómica. La mayoría de los elementos químicos tienen más de un isotopo Solamente 21 elementos (ejemplos: berilio,sodio poseen un solo isotopo natural; en contraste, el estaño es el elemento con más isotopos estables.
http://www.youtube.com/watch?v=kdwKumex7TE
LOS IONES
Los iones cargados negativamente, producidos por haber más electrones que protones, se conocen como aniones (que son atraídos por el ánodo) y los cargados positivamente, consecuencia de una pérdida de electrones, se conocen como cationes (los que son atraídos por el cátodo).
http://www.youtube.com/watch?v=alIIZ6WMQzc
DIMITRI MENDELEYEV
Dimitri Ivánovich Mendeléiev nació en Tobolks (Siberia) el 8 de febrero de1834. Era el menor de al menos 17 hermanos de la familia formada por Iván Pávlovich Mendeléyev y María Dmítrievna Mendeléyeva. En el mismo año en que nació, su padre quedó ciego perdiendo así su trabajo (era el director del colegio del pueblo). Recibían una pensión insuficiente, por lo que la madre tuvo que tomar las riendas de la familia y dirigir la fabrica de cristal que había fundado su abuelo.
Desde joven destacó en Ciencias en la escuela, no así en ortografía. Un cuñado suyo, exiliado por motivos políticos, y un químico de la fabrica le inculcaron el amor por las ciencias.
La familia sufrió, ya que Dimitri sólo terminó el bachillerato, murió su padre y se quemó la fábrica de cristal que dirigía su madre. Ésta apostó por invertir en la educación de Dimitri los ahorros guardados, en vez de reconstruir la fábrica. En esa época la mayoría de los hermanos, excepto una hermana, se habían independizado, y la madre se los llevó a Moscú para que Dimitri ingresase en la universidad. Sin embargo, Mendeléyev no fue admitido, quizá debido al clima político que existía en ese momento en Rusia, ya que no admitían en la universidad a nadie que no fuese de Moscú.
Los últimos años de la carrera los pasó en la enfermería debido a un erróneo diagnóstico de tuberculosis. Aun así, se graduó en 1855 como el primero de su clase y presentando su primera memoria de química sobre El isomorfismo en relación con otros puntos de contacto entre las formas cristalinas y la composición. Presentó la tesis Sobre volúmenes específicos para conseguir la plaza de maestro de escuela, y la tesis Sobre la estructura de las combinaciones silíceas para alcanzar la plaza de cátedra de química en la Universidad de San Petesburgo. A los 23 años era ya encargado de un curso de dicha universidad.

Retrato de Dmitri Mendeléyev por Ilia repin.
Gracias a una beca pudo ir a Heidelberg, donde realizó diferentes investigaciones junto a kirchhoff y Bunsen publicando un artículo sobre "La cohesión de algunos líquidos y sobre el papel de la cohesión molecular en las reacciones químicas de los cuerpos”. Este trabajo lo pudo realizar gracias a unos aparatos de precisión encargados en París con los cuales encontró la temperatura absoluta de ebullicion, y descubrió por qué algunos gases no se podían licuar (porque se encontraban por encima de la temperatura de ebullición).
Participó en el congreso de Karlsruhe donde quedó impresionado por las ideas sobre el peso de los elementos que planteó Cannizzaro. Al volver a San Petesburgo se encontró sin trabajo fijo, lo que le dio tiempo para escribir diferentes obras. Entre las cuales destaca su libro química orgánica, que escribió influido por lo que había escuchado en Karlsruhe.
Sobre la personalidad de Mendeléyev se puede decir que era un adicto al trabajo y su fama de mal carácter estaba basada en que mientras trabajaba, gritaba, gruñía y refunfuñaba. Se dice que alguien le preguntó sobre su mal genio, a lo que contestó que era una manera de mantenerse sano y no contraer úlcera.
En 1862 se casó, obligado por su hermana, con Feozva Nikítichna Lescheva con la que tuvo tres hijos, uno de los cuales falleció. Éste fue un matrimonio infeliz y desde 1871 vivieron separados.
Encontró la felicidad casándose con Anna Ivánovna Popova, 26 años menor que él. Para lograrlo, Mendeléyev estuvo cuatro años desesperado, incluso llegó a caer en una depresion, debido a que su mujer se negaba a concederle el divorcio y la familia de Anna se oponía tajantemente. A punto de darse por vencido consiguió el divorcio de su esposa y fue en busca de Anna que se encontraba en Roma. En 1882 contrajeron matrimonio. Tuvieron cuatro hijos.
En 1864 fue nombrado profesor de tecnología y química del instituto técnico de San Petesburgo. En 1861 ocupó la cátedra de química en la universidad de San Petesburgo donde estudió el isomorfismo, la compresion de los gases y las propiedades del aire enrarecido. Permanecería en esta cátedra 23 años. Mendeléyev estaba a favor de la introducción de reformas en el sistema educativo ruso. No consiguió ser elegido presidente de la academia imperial de ciencias debido a su liberalismo.
En 1890 terminó su estancia en la universidad debido a que intercedió por los estudiantes entregando una carta dirigida al Zar a Delianov, ministro de instrucción publica.

Escultura en honor a Mendeléyev y su tabla periódica, situada en Bratislava, Eslovaquia.
Éste se la devolvió con una nota adjunta que decía:
Por orden del ministro de Instrucción Pública, el papel que se adjunta se devuelve al Consejero de Estado, profesor Mendeléyev, ya que ni el ministro ni ninguno de los que están al servicio de su Majestad Imperial tiene derecho de recibir esta clase de papeles…
Indignado, Dmitri dejó las aulas de la universidad. Quizá por esto, se mantuvo desde entonces al margen de la política y del estado aunque manifestaba su oposición a la opresión y sus ideas liberales.
En 1865, tras la liberación de los siervos obtenida en 1861, decidió comprar una granja en la que puso en práctica métodos científicos para la mejora de la cosecha y tuvo una relación humanitaria con los campesinos. Obtuvo un rendimiento muy por encima de lo que se producía antes, por lo que muchos campesinos de granjas cercanas fueron a pedir su consejo.
En 1869 publicó la mayor de sus obras, Principios de química, donde formulaba su famosa tabla periodica, traducida a multitud de lenguas y que fue libro de texto durante muchos años.
En 1876 fue enviado a Estados Unidos, para informarse sobre la extracción del petróleo y ponerla luego en práctica en el Cáucaso. El estudio del refino del petróleo lo llevó a investigar el fenómeno de la atracción de las moléculas de cuerpos homogéneos o diferentes, materia que estudió hasta el día de su muerte. En 1887, publicó Estudio de las disoluciones acuosas según el peso específico, donde concluye que las soluciones contienen asociaciones de moléculas hidratadas en un estado de equilibrio móvil, que se disocian de diferentes maneras siguiendo el tanto por ciento de concentración.
En 1887 emprendió un viaje en globo en solitario para estudiar un eclipse solar.
En 1889 fue nombrado miembro honorario del consejo de consejo y manufacturas.
En 1890, por un encargo del Ministerio de guerra y marina, preparó una pólvora sin humo al pirocolodión.
En 1892 fue nombrado conservador científico de la oficina de pesas y medidas, en compensación por lo ocurrido en la universidad. Después de un año, tras haberlo reorganizado, es nombrado director, lo que lo compromete a realizar diversos viajes, entre los que se encuentra el realizado a Londres donde recibe los doctorados honoris causa de las universidades de Cambridge y Oxford.
En 1902, viajó a París y visitó al matrimonio de los Curie, Marie y Pierre, en su laboratorio. Observó el experimento de la fosforescencia del sulfuro de cinc debida a los rayos X, y concluyó que “en los cuerpos radiactivos existía un gas etéreo que provocaba vibraciones luminosas y que entraba y salía de los cuerpos como un cometa entra y sale del sistema solar”.
No lo terminó de convencer la teoría de la radiactividad y la estructura del átomo. Consideraba la radiactividad como una propiedad o un estado de las sustancias, mientras que los átomos y moléculas no existían realmente aunque sí lo hacía la energía.
Falleció el 2 de febrero de 1907 casi ciego. Se considera a Mendeléyev un genio, no sólo por el ingenio que mostró para aplicar todo lo conocido y predecir lo no conocido sobre los elementos químicos, plasmándolo en su tabla periódica, sino por los numerosos trabajos realizados a lo largo de toda su vida en diversos campos de la ciencia, agricultura, ganadería, industria, petróleo, etc.
Viajó por toda Europa visitando a diversos científicos.
En Rusia nunca se lo reconoció debido a sus ideas liberales, por lo que nunca fue admitido en la Academia Rusa de las ciencias. Sin embargo, en 1955 se nombró mendelevio (Md) al elemento químico de número atómico 101 en homenaje al ilustre científico ruso.
http://www.youtube.com/watch?v=Lw2GLNtDIIc
LA ENERGÍA
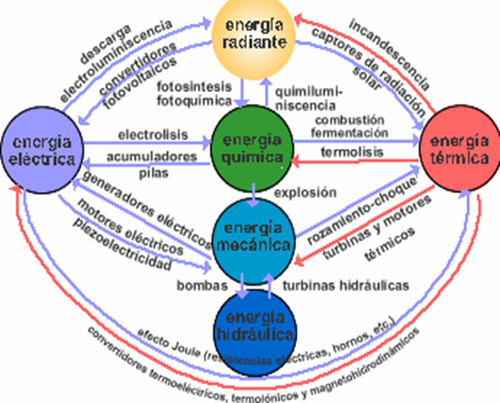
Mecánica clásica
En física clásica, la ley universal de conservación de la energía que es el fundamento del primer principio de la termodinámica, indica que la energía ligada a un sistema aislado permanece constante en el tiempo. Eso significa que para multitud de sistemas físicos clásicos la suma de la energía mecánica, la energía calorífica, la energía electromagnética, y otros tipos de energía potencial es un número constante. Por ejemplo, la energía cinética se cuantifica en función del movimiento de la materia, la energía potencial según propiedades como el estado de deformación o a la posición de la materia en relación con las fuerzas que actúan sobre ella, la energía térmica según su capacidad calorífica, y la energía química según la composición química.Mecánica cuántica
Sin embargo, debe tenerse en cuenta que según la teoría de la relatividad la energía definida según la mecánica clásica no se conserva constante, sino que lo que se conserva en es la masa-energía equivalente. Es decir, la teoría de la relatividad especial establece una equivalencia entre masa y energía por la cual todos los cuerpos, por el hecho de estar formados de materia, poseen una energía adicional equivalente a , y si se considera el principio de conservación de la energía esta energía debe ser tomada en cuenta para obtener una ley de conservación (naturalmente en contrapartida la masa no se conserva en relatividad, sino que la única posibilidad para una ley de conservación es contabilizar juntas la energía asociada a la masa y el resto de formas de energía).
, y si se considera el principio de conservación de la energía esta energía debe ser tomada en cuenta para obtener una ley de conservación (naturalmente en contrapartida la masa no se conserva en relatividad, sino que la única posibilidad para una ley de conservación es contabilizar juntas la energía asociada a la masa y el resto de formas de energía).
LA ENERGÍA

Mecánica clásica
En física clásica, la ley universal de conservación de la energía que es el fundamento del primer principio de la termodinámica, indica que la energía ligada a un sistema aislado permanece constante en el tiempo. Eso significa que para multitud de sistemas físicos clásicos la suma de la energía mecánica, la energía calorífica, la energía electromagnética, y otros tipos de energía potencial es un número constante. Por ejemplo, la energía cinética se cuantifica en función del movimiento de la materia, la energía potencial según propiedades como el estado de deformación o a la posición de la materia en relación con las fuerzas que actúan sobre ella, la energía térmica según su capacidad calorífica, y la energía química según la composición química.Mecánica cuántica
Sin embargo, debe tenerse en cuenta que según la teoría de la relatividad la energía definida según la mecánica clásica no se conserva constante, sino que lo que se conserva en es la masa-energía equivalente. Es decir, la teoría de la relatividad especial establece una equivalencia entre masa y energía por la cual todos los cuerpos, por el hecho de estar formados de materia, poseen una energía adicional equivalente a
 , y si se considera el principio de conservación de la energía esta energía debe ser tomada en cuenta para obtener una ley de conservación (naturalmente en contrapartida la masa no se conserva en relatividad, sino que la única posibilidad para una ley de conservación es contabilizar juntas la energía asociada a la masa y el resto de formas de energía).
, y si se considera el principio de conservación de la energía esta energía debe ser tomada en cuenta para obtener una ley de conservación (naturalmente en contrapartida la masa no se conserva en relatividad, sino que la única posibilidad para una ley de conservación es contabilizar juntas la energía asociada a la masa y el resto de formas de energía).
Energía en diversos tipos de sistemas físicosLa energía también es una magnitud física que se presenta bajo diversas formas, está involucrada en todos los procesos de cambio de estado físico, se transforma y se transmite, depende del sistema de referencia y fijado éste se conserva.Por lo tanto, todo cuerpo es capaz de poseer energía en función de su movimiento, posición, temperatura, masa, composición química, y otras propiedades. En las diversas disciplinas de la física y la ciencia, se dan varias definiciones de energía, todas coherentes y complementarias entre sí, y todas ellas siempre relacionadas con el concepto de trabajo.
En la mecánica se encuentran:
Energía mecánica, que es la combinación o suma de los siguientes tipos:
Energía cinética: relativa al movimiento.
Energía potencial: la asociada a la posición dentro de un campo de fuerzas conservativo. Por ejemplo, está la Energía potencial gravitatoria y la Energía potencial elástica (o energía de deformación, llamada así debido a las deformaciones elásticas). Una onda también es capaz de transmitir energía al desplazarse por un medio elástico.
En electromagnetismo se tiene a la:
Energía electromagnética, que se compone de:
Energía radiante: la energía que poseen las ondas electromagnéticas.
Energía calórica: la cantidad de energía que la unidad de masa de materia puede desprender al producirse una reacción química de oxidación.
Energía eléctrica: resultado de la existencia de una diferencia de potencial entre dos puntos.
En la termodinámica están:
Energía interna, que es la suma de la energía mecánica de las partículas constituyentes de un sistema.
Energía térmica, que es la energía liberada en forma de calor.
Potencial termodinámico, la energía relacionada con las variables de estado.
En la termodinámica están:
Energía interna, que es la suma de la energía mecánica de las partículas constituyentes de un sistema.
Energía térmica, que es la energía liberada en forma de calor.
Potencial termodinámico, la energía relacionada con las variables de estado.
Física relativista
En la relatividad están:
Energía en reposo, que es la energía debida a la masa según la conocida fórmula de Einstein, E=mc2, que establece la equivalencia entre masa y energía.
Energía de desintegración, que es la diferencia de energía en reposo entre las partículas iniciales y finales de una desintegración.
Al re definir el concepto de masa, también se modifica el de energía cinética
En la relatividad están:
Energía en reposo, que es la energía debida a la masa según la conocida fórmula de Einstein, E=mc2, que establece la equivalencia entre masa y energía.
Energía de desintegración, que es la diferencia de energía en reposo entre las partículas iniciales y finales de una desintegración.
Al re definir el concepto de masa, también se modifica el de energía cinética
Física cuántica
En física cuántica, la energía es una magnitud ligada al operador hamiltoniano. La energía total de un sistema no aislado de hecho puede no estar definida: en un instante dado la medida de la energía puede arrojar diferentes valores con probabilidades definidas. En cambio, para los sistemas aislados en los que el hamiltoniano no depende explícitamente del tiempo, los estados estacionarios sí tienen una energía bien definida. Además de la energía asociadas a la materia ordinaria o campos de materia, en física cuántica aparece la:
Energía del vació: un tipo de energía existente en el espacio, incluso en ausencia de materia.
Energía del vació: un tipo de energía existente en el espacio, incluso en ausencia de materia.
Química
En química aparecen algunas formas específicas no mencionadas anteriormente:
Energía de ionización, una forma de energía potencial, es la energía que hace falta para ionizar una molécula o átomo.
Energía de enlace, es la energía potencial almacenada en los enlaces químicos de un compuesto. Las reacciones químicas liberan o absorben esta clase de energía, en función de la entalpia y energía calorica. Si estas formas de energía son consecuencia de interacciones biológicas, la energía resultante es bioquímica, pues necesita de las mismas leyes físicas que aplican a la química, pero los procesos por los cuales se obtienen son biológicos, como norma general resultante del metabolismo celular.
En química aparecen algunas formas específicas no mencionadas anteriormente:
Energía de ionización, una forma de energía potencial, es la energía que hace falta para ionizar una molécula o átomo.
Energía de enlace, es la energía potencial almacenada en los enlaces químicos de un compuesto. Las reacciones químicas liberan o absorben esta clase de energía, en función de la entalpia y energía calorica. Si estas formas de energía son consecuencia de interacciones biológicas, la energía resultante es bioquímica, pues necesita de las mismas leyes físicas que aplican a la química, pero los procesos por los cuales se obtienen son biológicos, como norma general resultante del metabolismo celular.
Energía potencial
Es la energía que se le puede asociar a un cuerpo o sistema conservativo en virtud de su posición o de su configuración. Si en una región del espacio existe un campo de fuerzas conservativo, la energía potencial del campo en el punto (A) se define como el trabajo requerido para mover una masa desde un punto de referencia (nivel de tierra) hasta el punto (A). Por definición el nivel de tierra tiene energía potencial nula. Algunos tipos de energía potencial que aparecen en diversos contextos de la física son:
La energía potencial gravitatoria asociada a la posición de un cuerpo en el campo gravitatorio (en el contexto de la mecánica clásica). La energía potencial gravitatoria de un cuerpo de masa m en un campo gravitatorio constante viene dada por: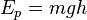 donde h es la altura del centro de masas respecto al cero convencional de energía potencial.
donde h es la altura del centro de masas respecto al cero convencional de energía potencial.
La energía potencial electrostática V de un sistema se relaciona con el campo eléctrico mediante la relación:
 siendo E el valor del campo eléctrico.
siendo E el valor del campo eléctrico.
Es la energía que se le puede asociar a un cuerpo o sistema conservativo en virtud de su posición o de su configuración. Si en una región del espacio existe un campo de fuerzas conservativo, la energía potencial del campo en el punto (A) se define como el trabajo requerido para mover una masa desde un punto de referencia (nivel de tierra) hasta el punto (A). Por definición el nivel de tierra tiene energía potencial nula. Algunos tipos de energía potencial que aparecen en diversos contextos de la física son:
La energía potencial gravitatoria asociada a la posición de un cuerpo en el campo gravitatorio (en el contexto de la mecánica clásica). La energía potencial gravitatoria de un cuerpo de masa m en un campo gravitatorio constante viene dada por:
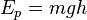 donde h es la altura del centro de masas respecto al cero convencional de energía potencial.
donde h es la altura del centro de masas respecto al cero convencional de energía potencial.La energía potencial electrostática V de un sistema se relaciona con el campo eléctrico mediante la relación:
 siendo E el valor del campo eléctrico.
siendo E el valor del campo eléctrico.
La energía potencial elástica asociada al campo de tensiones de un cuerpo deformable.
La energía potencial puede definirse solamente cuando existe un campo de fuerzas que es conservativa, es decir, que cumpla con alguna de las siguientes propiedades:
El trabajo realizado por la fuerza entre dos puntos es independiente del camino recorrido.
El trabajo realizado por la fuerza para cualquier camino cerrado es nulo.
Cuando el rotor de F es cero (sobre cualquier dominio simplemente conexo).
Se puede demostrar que todas las propiedades son equivalentes (es decir que cualquiera de ellas implica la otra). En estas condiciones, la energía potencial en un punto arbitrario se define como la diferencia de energía que tiene una partícula en el punto arbitrario y otro punto fijo llamado "potencial cero".
La energía potencial puede definirse solamente cuando existe un campo de fuerzas que es conservativa, es decir, que cumpla con alguna de las siguientes propiedades:
El trabajo realizado por la fuerza entre dos puntos es independiente del camino recorrido.
El trabajo realizado por la fuerza para cualquier camino cerrado es nulo.
Cuando el rotor de F es cero (sobre cualquier dominio simplemente conexo).
Se puede demostrar que todas las propiedades son equivalentes (es decir que cualquiera de ellas implica la otra). En estas condiciones, la energía potencial en un punto arbitrario se define como la diferencia de energía que tiene una partícula en el punto arbitrario y otro punto fijo llamado "potencial cero".
Energía cinética de una masa puntual
La energía cinética es un concepto fundamental de la física que aparece tanto en mecánica clásica, como mecánica relativista y mecánica cuántica. La energía cinética es una magnitud escalar asociada al movimiento de cada una de las partículas del sistema. Su expresión varía ligeramente de una teoría física a otra. Esta energía se suele designar como K, T o Ec.
El limite clásico de la energía cinética de un cuerpo rígido que se desplaza a una velocidad v viene dada por la expresión:
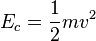
Una propiedad interesante es que esta magnitud es extensiva por lo que la energía de un sistema puede expresarse como "suma" de las energía de partes disjuntas del sistema. Así por ejemplo puesto que los cuerpos están formados de partículas, se puede conocer su energía sumando las energías individuales de cada partícula del cuerpo.
La energía cinética es un concepto fundamental de la física que aparece tanto en mecánica clásica, como mecánica relativista y mecánica cuántica. La energía cinética es una magnitud escalar asociada al movimiento de cada una de las partículas del sistema. Su expresión varía ligeramente de una teoría física a otra. Esta energía se suele designar como K, T o Ec.
El limite clásico de la energía cinética de un cuerpo rígido que se desplaza a una velocidad v viene dada por la expresión:
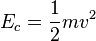
Una propiedad interesante es que esta magnitud es extensiva por lo que la energía de un sistema puede expresarse como "suma" de las energía de partes disjuntas del sistema. Así por ejemplo puesto que los cuerpos están formados de partículas, se puede conocer su energía sumando las energías individuales de cada partícula del cuerpo.
Transformación de la energía
Para la optimización de recursos y la adaptación a nuestros usos, necesitamos transformar unas formas de energía en otras. Todas ellas se pueden transformar en otra cumpliendo los siguientes principios termodinámicos:
“La energía no se crea ni se destruye; sólo se transforma”. De este modo, la cantidad de energía inicial es igual a la final.
“La energía se degrada continuamente hacia una forma de energía de menor calidad (energía térmica)”. Dicho de otro modo, ninguna transformación se realiza con un 100% de rendimiento, ya que siempre se producen unas pérdidas de energía térmica no recuperable. El rendimiento de un sistema energético es la relación entre la energía obtenida y la que suministramos al sistema.
Unidades de medida de energía
La unidad de energía definida por el sistema internacional de unidades es el julio, que se define como el trabajo realizado por una fuerza de un newton en un desplazamiento de un metro en la dirección de la fuerza, es decir, equivale a multiplicar un Newton por un metro. Existen muchas otras unidades de energía, algunas de ellas en desuso.
http://www.youtube.com/watch?v=njDoA2VFJmc
Para la optimización de recursos y la adaptación a nuestros usos, necesitamos transformar unas formas de energía en otras. Todas ellas se pueden transformar en otra cumpliendo los siguientes principios termodinámicos:
“La energía no se crea ni se destruye; sólo se transforma”. De este modo, la cantidad de energía inicial es igual a la final.
“La energía se degrada continuamente hacia una forma de energía de menor calidad (energía térmica)”. Dicho de otro modo, ninguna transformación se realiza con un 100% de rendimiento, ya que siempre se producen unas pérdidas de energía térmica no recuperable. El rendimiento de un sistema energético es la relación entre la energía obtenida y la que suministramos al sistema.
Unidades de medida de energía
La unidad de energía definida por el sistema internacional de unidades es el julio, que se define como el trabajo realizado por una fuerza de un newton en un desplazamiento de un metro en la dirección de la fuerza, es decir, equivale a multiplicar un Newton por un metro. Existen muchas otras unidades de energía, algunas de ellas en desuso.
| Nombre | Abreviatura | Equivalencia en julios |
|---|---|---|
| Caloría | cal | 4,1855 |
| Frigoría | fg | 4185,5 |
| Termia | th | 4 185 500 |
| Kilovatio hora | kWh | 3 600 000 |
| Caloría grande | Cal | 4185,5 |
| Tonelada equivalente de petróleo | Tep | 41 840 000 000 |
| Tonelada equivalente de carbón | Tec | 29 300 000 000 |
| Tonelada de refrigeración | TR | 3,517/h |
| Electronvoltio | eV | 1,602176462 × 10-19 |
| British Thermal Unit | BTU o BTu | 1055,05585 |
| Caballo de vapor por hora2 | CVh | 3,777154675 × 10-7 |
| Ergio | erg | 1 × 10-7 |
| Pie por libra (Foot pound) | ft × lb | 1,35581795 |
| Foot-poundal3 | ft × pdl | 4,214011001 × 10-11 |
